Ⅱ. 肺炎球菌の基礎
1. 莢膜と薬剤標的のPBP
1) 莢膜の多様性
肺炎球菌において病原因子として最も重要な莢膜の型は、図-7に示すように現在97種類が報告されている(Geno KA, et al., Clin Microbiol Rev. 2015 ; 28 : 871-899)。これらは抗原性の違いから24のシングルタイプとひとつのタイプに複数以上を含むグループタイプに識別される。例えば,6型グループは正確には6A,6B,6C,6D,6Eの5型を含むが,これらをすべて正確に型別することが必要である。
その理由は,PCV13には含まれていなくとも,「交差免疫:cross immunity」を示しワクチン効果を期待できるタイプがあることによる。6Bは6Aと,6Aは6Cと交差免疫性を示すが,19Fと19Aでは交差免疫性は認められていない。なお,2018年現在,SSIから購入可能な抗血清を用いて型別できるのは,92種類である。
なお,多様な莢膜型の型別には,先に記した型別用抗血清を用いる方法で行い,PBP遺伝子解析データと併せて判定する手法が最も優れている(図-11参照)。抗血清を用いるため,莢膜型別は血清型別(serotyping)とも表記される。
繰り返すが,肺炎球菌における莢膜の多様性は,本菌がヒト生体内に侵入するために菌側に本質的に備わったヒト免疫回避システムである。菌の進化ともいえる莢膜の多様性は,本菌が容易に死滅しやすいという特徴を有しながらも,漏出したDNAを巧みに莢膜型が異なる菌へ取り込み,自らを変化させてヒトとともに生き延びる能力を有していることを物語っている。
本菌におけるこの本質は将来においても変化することはないであろう。
2) PBP遺伝子の変異の特徴
肺炎球菌の耐性化は,常在細菌として棲息する上咽頭環境で暴露される薬剤濃度抜きには理解できない。これはβ-ラクタム系薬に限らずマクロライド系薬やニューキノロン系薬でも同様である。ペニシリン系経口薬のアンピシリンやアモキシシリン,あるいは経口セフェム系薬の通常投与量で得られる血中濃度あるいは組織濃度は極めて低い(各薬剤の添付文書参照のこと)。

- 図-8
- β-ラクタム系薬耐性化に重要なPBP酵素のアミノ酸置換
このため耐性化に関与するPBPが変異(正しくはアミノ酸置換; substitution of amino acid)していたとしても,感受性の低下は微妙で生物学的感受性測定(bioassay)では識別困難なことが多い。
私達は収集した菌株について,図-8に示す4種の細胞壁合成酵素(PBP)をコードするそれぞれの遺伝子,すなわちPBP1A(pbp1a), PBP2B( pbp2b), PBP2X(pbp2x), およびPBP2A(pbp2a)遺伝子を塩基解析し,さらに肺炎球菌に系統の異なるβ-ラクタム系薬を作用させた後の形態変化の違いから次のように結論した。
すなわち,
- 各pbp遺伝子は上流域にトランスグリコシラーゼ活性,下流域にトランスペプチダーゼ活性をコードしている。
- β-ラクタム系薬の作用発現には,トランスペプチダーゼ領域の保存性アミノ酸配列(conserved amino acid), すなわちSTM(V)K,SS(R)N,およびKT(S)Gのアミノ酸置換あるいは近位のアミノ酸置換が最も重要である。
- PBP1Aは細胞分裂時の長軸に細胞壁を伸長させる合成酵素である。セフェム系薬よりもペニシリン系薬とカルバペネム系,とくにパニペネムの結合性(親和性と表現)が高く,その酵素活性を強く阻害する。つまりPBP1Aの保存性アミノ酸配列に置換があればそれらの感受性が低下する。
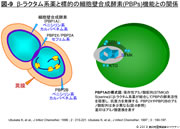
- 図-9
- β-ラクタム系薬と標的の細胞壁合成酵素(PBPs)機能との関係
- PBP2Xおよびその代替酵素と推定されるPBP2Aは,分裂時の隔壁合成酵素である。この酵素にはセフェム系薬の親和性が高く,その酵素活性が阻害されると菌は分裂が阻害され著しく伸長化する。この酵素にアミノ酸置換が生ずると,セフェム系薬の感受性が著しく低下する。
- PBP2Bは本菌の特徴的な細胞分裂の最終段階であるランセット型の先端構造の合成に関わる酵素である。この遺伝子では保存性アミノ酸配列のKTG領域に10個のアミノ酸置換が存在する。PBP2Bに対してはペニシリン系薬とカルバペネム系薬の親和性が優れ,この遺伝子にアミノ酸置換が生ずるとそれらの感受性が低下する(図-9)。
保存性アミノ酸配列とその近位のアミノ酸置換が重要であることは,その後の3次元解析から明らかにされている(Asahi Y, et al, Antimicrob Agents Chemother. 1999 ; 43 : 1252-1255)。
3) PBP変異と感受性の関係

- 図-10
- 耐性遺伝子とペニシリンG感受性(n = 633)
PBP遺伝子解析結果と生物学的手法による感受性結果はどのように関連しているのか,その関係を図-10に示す。併せて2014年時の米国CLSI (Clinical and Laboratory Standards Institute) によるブレイクポイントも示した。その他にEUCAST (European Committee on Antimicrobial Susceptibility Testing) の基準もある。そもそも投与量が異なるわが国の臨床には,国外の識別基準をそのまま安易に適応しない方がよいことを強調しておく。また,経口薬と注射薬では薬物の移行濃度が根本的に異なるので,その点でも留意する必要がある。生物学的測定によるMICはばらつきが大きく絶対的な値ではない。その点遺伝子識別の方が再現性に優れているといえる。
図中では遺伝子学的変異を持たない菌はgenotypeを表す”g”を付けてgPSSP(penicillin-susceptible S. pneumonaie),pbp2x遺伝子変異株はgPISP(pbp2x),2つのpbp遺伝子が変異した株はそれぞれgPISP(pbp1a+pbp2x), gPISP(pbp1a+pbp2b),あるいはgPISP(pbp2x+pbp2b),そして3つのPBP遺伝子が変異した株をgPRSP(pbp1a+pbp2x+pbp2b)と表記している。
試験管1管の差で遺伝子変異の異なることが明らかであるが,これらの差を生物学的手法では正確に識別できないことからPCRによる迅速診断法の確立へと繋がっている。
4) 血清型別と耐性遺伝子の迅速解析
pbp遺伝子に多様な変異が認められる肺炎球菌の遺伝子解析には,逆転の発想が必要であった。すなわち,耐性化に必須の各PBPの保存性アミノ酸配列,あるいは近位アミノ酸に置換のないpbp遺伝子を検索できるようプライマーを設計することである。つまり,構築したプライマーでDNAの増幅が認められれば「変異なし」,増幅されなければ「変異あり」と判定する方法である。
現在,私達が構築したPBP遺伝子解析法は,蛍光プローブ(サイクリーブプローブ)を用いる方法へ改良してキット化され,研究用試薬として用いられている(タカラバイオ㈱)。キットはpbp遺伝子のみならず,肺炎球菌同定用の自己融解酵素遺伝子(lytA)とマクロライド系薬耐性遺伝子(mefAとermB)も併せて検索できる。
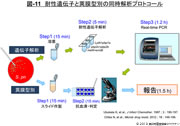
- 図-11
- 耐性遺伝子と莢膜型別の同時解析プロトコール
遺伝子解析プロトコールは図-11に示すが,釣菌後PCR機器にセットしスタートすれば,データはコンピューター画面上にリアルタイムに表示され,最終結果は1.5時間以内に得ることができる。並行して莢膜型別用のプレパラートを作製しておき,PCRの結果を元に型別用抗血清を用いて血清型別を実施する。先に遺伝子変異を確定することにより,私達の今までの膨大なデータを元に被験菌の推定血清型を絞り込むことができる。サーベイランスではこのようにして収集された肺炎球菌を解析,結果は直ちに各医療機関へ報告してきた。
2. 莢膜を標的としたワクチン開発
1) ワクチン標的としての莢膜
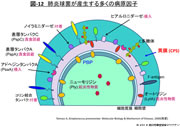
- 図-12
- 肺炎球菌が産生する多くの病原因子
図-12示すように,肺炎球菌は多くの病原因子を保持することが知られている。
侵入に関わるヒアルロニダーゼ,付着に関わるノイラミニダーゼやコリン結合タンパク,多核白血球による貪食からの回避のための表層タンパクPspAやPspC,起炎物質のニューモリジンやオートリジン,そして感染症診断用に欠かすことのできないCRP検査と関連するC多糖体などである。
それらの中でも最も重要なのは,菌の表層全体を覆う多糖体(polysaccharide)で出来た莢膜(capsule)である。莢膜は多核白血球による貪食回避に最も重要な役割を担っているが,先に記したように莢膜型は現在97タイプが報告され,極めて多様性に富んでいる。抗原としては最も明確でワクチンはこの多糖体を抽出・精製して作製されている。
2) PCV13とPPSV23の作製法の違い
肺炎球菌ワクチンには,現在「沈降13価肺炎球菌結合型ワクチン(PCV13:13-valent pneumococcal conjugate vaccine)」と「23価肺炎球菌莢膜ポリサッカライドワクチン(PPSV23:23-valent pneumococcal polysaccharide vaccine)」の2種がある。PCV13の製品名はプレベナー13®,PPSV23のそれはニューモバックスNP®である(各ワクチンの添付文書参照)。
PCV13は,精製した13のタイプの多糖体(1, 3, 4, 5, 6A, 6B, 7F, 9V, 14, 18C, 19A, 19F, 23F)それぞれに無毒化したジフテリアトキソイドタンパク(CRM197)を結合させたものを充填したものである。タンパクを結合させてあるため,高い免疫原性(抗原性)を有していることが特徴である。PCV13は現在,生後2か月から5歳未満児に対して「定期接種化」され(任意接種としては5歳以上6歳未満に接種可能),65歳以上には「任意接種」として適応が拡大されている。
PPSV23は,精製した23のタイプの多糖体(1, 2, 3, 4, 5, 6B, 7F, 8, 9N, 9V, 10A, 11A, 12F, 14, 15B, 17F, 18C, 19A, 19F, 20, 22F, 23F, 33F)のみを含むバイアルである。本邦では2014年(H26)10月に65歳以上と60歳以上65歳未満のハイリスク者への定期接種が2019年3月末までの5年間の経過措置付きで施行されている。
3) PCV13とPPSV23の抗体産生誘導の違い
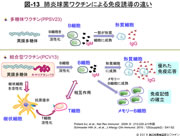
- 図-13
- 肺炎球菌ワクチンによる免疫誘導の違い
PCV13とPPSV23では接種後に誘導される抗体産生に決定的な違いがある(図-13)。
CRM197を結合させたPCV13の接種は,先ず樹状細胞に抗原が提示されてT細胞の活性化を誘導する(T細胞依存型)。次いで活性化したT 細胞とB細胞の相互作用によりB細胞が活性化する。その後一つの経路はB細胞からのIgMの産生を経て,形質細胞への成熟によりIgGが大量に産生される。IgGは抗原に対する親和性が高く,オプソニンや補体の活性化,あるいは抗原の中和に関与する。もう一つの経路は,B細胞がメモリーB細胞へと成熟し,免疫記憶が獲得されることである。記憶された莢膜型の菌が侵入することがあれば,速やかに高いIgG抗体産生能が誘導(ブースター効果)され免疫能が高まることになる。
それに対し,PPSV23は多糖体のみのためT細胞を介した免疫記憶の獲得は成立しない(T細胞非依存型)。B 細胞活性化から一部のB細胞が形質細胞に成熟して産生するIgGのみである。したがっていったん得られたIgG抗体は経年的に次第に減弱する。抗体が減弱した時点でワクチンに含まれる莢膜型の菌による感染が生じた際にはワクチン効果は期待できない。このため,PPSV23は接種後5年以上経過した後の再接種が議論されている。
両ワクチンの使い分けを科学的に考察すると,成人においても優れた免疫応答と免疫記憶の成立するPCV13が先に接種されることが理にかなっている。
また,肺炎球菌は乳幼児の鼻腔や上咽頭の粘膜に高頻度に定着して常在細菌の一面を有しているが,このコロナイズした菌が中耳炎,副鼻腔炎,あるいは急性気管支炎や肺炎などの感染症成立のリザーバーとなっている。成人でも肺炎球菌を保菌している場合が少なからず認められる。PCV13は粘膜における免疫も誘導して肺炎球菌の定着を予防するが,PPSV23にはこのような予防効果は認められていない。
3. ヒト多核白血球による肺炎球菌の貪食作用
動画-1(約1分)には位相差顕微鏡下に動画撮影されたヒト多核白血球による黄色ブドウ球菌と大腸菌の貪食作用の様子を肺炎球菌との比較のために示す。細胞壁の外側に莢膜等を持たないこれらの菌では,白血球が能動的に菌に近づき,瞬く間(20分~30分)にリゾチームを産生して溶菌してしまう。
ところが,ヒト多核白血球による肺炎球菌の貪食は,動画-2(約1分)に示したように白血球に貪食され難いことが特徴である。莢膜6B型と莢膜3型肺炎球菌に対する白血球の貪食作用の様子を撮影している。前者は血液寒天培地上に中心部が陥没した典型的な微小コロニーを形成するのに対し,後者の3型菌は「ムコイド型」と呼ばれる粘調性のある大きく盛り上がったコロニーを形成する菌である。ムコイド型を呈するのは厚い莢膜を保持するためであるが,動画を注意深く観察すると,菌が白血球を撥ねて寄せ付けない様子が判る。この性状ゆえにひとたび3型菌で発症すると,重篤化しやすいのである。重症肺炎や膿胸を惹起しやすく,成人IPDの15%はこのタイプの肺炎球菌で発症している。また,小児・成人にみられるムコーズス中耳炎も3型菌に起因する例が圧倒的に多い。



